背景:白血病是造血系統的一種惡性疾病,在我國各年齡組惡性腫瘤的死亡率中分別占第6位(男性 )和第8位(女性),在兒童及35歲以下的死亡率中占第1位。白血病按起病的緩急可分為急、慢性白血病。急性白血病細胞分化停滯在早期階段,以原始及早幼細胞為主,疾病發展迅速,病程數月。慢性白血病細胞分化較好,以幼稚或成熟細胞為主,發展緩慢,病程數年。按病變細胞系列分類,包括髓系的粒、單、紅、巨核系和淋巴系的T和B細胞系。臨床上常將白血病分為急性淋巴細胞白血病(ALL)、急性髓細胞白血病(AML)、慢性粒細胞白血病、慢性淋巴細胞白血病等。
急性B淋巴細胞白血病(B-ALL),慢性B淋巴細胞白血病(B-CLL),霍奇金淋巴瘤(HL),非霍奇金淋巴瘤(NHL)的臨床治療,目前以化療、干細胞移植及生物治療等為主,雖然可以取得一定的療效,但復發難治仍然是難以攻克的重點,腫瘤的細胞免疫治療作為一種新的治療策略,成為當今研究的熱點。CD19 幾乎表達于所有的B 細胞腫瘤細胞表面,而其他實質細胞和造血干細胞幾 乎不表達,因此作為B 細胞腫瘤抗原的特異性高。利用抗CD19 scFv 構建的嵌合抗原受體(CAR)表達于T 細胞表面,可使T 細胞特異性殺傷CD19 陽性的腫瘤細胞。全球數家公司的CAR-T療法已經在白血病患者中產生令人印象深刻的緩解率,但較高的復發率影響了它們長遠發展的潛力。CAR-T技術的研究者不得不面對一個問題,即T細胞上CAR的結構缺乏持續性,或者不能夠在體內產生足夠的 持續性的有效性。理論上,常規使用的鼠源CARs會被免疫系統所排斥。費城兒童醫院一位緩解期的 患者對鼠源的CTL019沒有反應,這是非常讓人印象深刻的一件事情。而且由于不同的公司設計的CA R的結構有差異,例如Kite公司采用伽馬逆轉錄病毒轉染進行結構構建,采用CD28共刺激域,而諾華公司使用慢病毒轉染和4-1BB共刺激域,使得CAR的結構設計顯得至關重要。另外,CAR-T細胞中C D4:CD8的比例,調節性T細胞以及具有干細胞特性的記憶性T細胞的含量也影響CAR-T在體內的存活 時間和殺傷效能。因此,有必要開發新一代體內持續時間長、更為有效的、針對CD19靶點的CAR-T ,用于CD19陽性腫瘤的臨床治療。
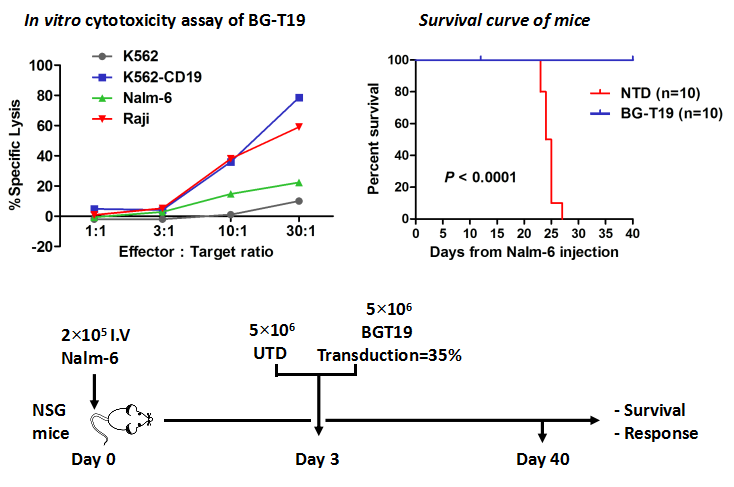
公司在現有基礎上,開發出了新一代針對CD19抗原的CAR-T細胞治療CD19陽性腫瘤的產品BG-19(CD19-CAR-T),用于CD19陽性腫瘤的臨床治療,其在體內持續時間更長、療效更好。已完成臨床前研究,并與醫院合作開展臨床治療10例,9例MRD陰性出院,1例在回輸后2月進行骨髓移植(不進行療效評價),1例無效。
3.2.2 BG-22(anti-CD22 CAR-T)
背景:全球數家公司的CAR-T療法已經在白血病患者中產生令人印象深刻的緩解率,但較高的復發率影響了它們長遠發展的潛力。在國外針對CD19的CAR-T臨床試驗中發現,三分之二的復發是由于CD19抗原的缺失導致的逃逸。為了克服這個問題,顯然需要一個完全不同的治療方法。一個策略是靶向另一個抗原,很幸運,在B細胞惡性腫瘤的表面存在一個替代的抗原:CD22。美國著名生物制藥公司Juno Therapeutics在復發的或者難以治療的急性B細胞淋巴癌(r/r ALL)兒童及年輕成人患者的治療中已經有Ⅰ期的臨床數據。其臨床初步結果展示了靶向CD22抗原的良好的安全性,臨床療效也令人欣慰。公司研發的BG-22(CD22-CAR-T)是一種靶向于CD22嵌合抗原受體(Chimeric Antigen Receptor,CAR)T細胞產品。公司正在進行靶向于CD19的一系列CAR-T產品研究,前期針對B-ALL的臨床效應使我們深受鼓舞。BG-22(CD22-CAR-T)的開發給我們提供了進一步改善靶向CD19治療效果的兩種方式,我們不但可以將靶向CD22的CAR-T單獨用于治療CD19陰性患者,更可以將BG-19(CD19-CAR-T)和BG-22(CD22-CAR-T)聯合使用,以減少產生耐藥細胞的風險,同時使更多的B細胞瘤患者獲得長期緩解。公司開發的BG-22(CD22-CAR-T)正在進行臨床前試驗。
3.2.3 BG-BCMA(anti-BCMA CAR-T)
背景: 多發性骨髓瘤(MM)是以克隆性漿細胞大量增生為特征的惡性腫瘤,在血液瘤中屬于第二常見的病種。漿細胞是由B細胞成熟演變而來,根據異常漿細胞增生時所產生的單克隆免疫球蛋白特征,MM又可被分為8個不同亞型: IgG型,IgD型,IgA型,IgE型,IgM型,輕鏈型,雙克隆型和不分泌型。雖然部分MM患者在接受放化療和造血干細胞移植后可得到一定程度的緩解,但幾乎所有患者最終仍會復發并死亡。加上MM的惡性漿細胞很少表達CD19,因此需要為MM治療開發新療法和更好的靶點。BCMA可結合B細胞激活因子(BAFF)和增殖誘導配體(APRIL),是一種重要的B細胞生物標志物。BCMA在正常的細胞中主要由漿細胞和一部分成熟B細胞表達,而在大部分B細胞以及其它器官上都不表達。MM惡性漿細胞中常能檢測到BCMA的RNA和蛋白,因此它是理想的CAR-T靶點之一。目前以B細胞成熟抗原(B Cell Maturation Antigen,BCMA,CD269)為靶點而開發的新一代CAR-T,其中包括南京傳奇生物、Bluebird bio、Celgene、Novartis、Kite Pharma、Juno Therapeutics等生物醫藥公司,以及參與BCMA研究的賓夕法尼亞大學Abramson癌癥中心、紀念斯隆凱特林癌癥中心(MSKCC)、國立癌癥研究所(NCI)、中國西南醫院和斯克里普斯研究所等主要科研單位。多個臨床試驗數據顯示,靶向BCMA 的CAR-T療法可的緩解率可達100%,潛力巨大。
為此,公司以靶向CD19抗原的CAR-T療法的成功案例為藍本,開發BCMA特異性的CAR-T細胞治療多發性骨髓瘤(MM)的技術。目前正進行人源抗體噬菌體庫和羊駝免疫篩選,預計可獲得具有自主知識產權的BCMA抗體。公司將對抗體的親力、CAR結構和細胞制備工藝進行優化,控制造血干細胞毒性,完成臨床前研究及臨床申報。
3.2.4 UBG-19(通用型CD19-CAR-T)
背景:因受限于免疫系統自身的某些限制性因素,如CAR-T異體回輸時由于免疫原性等原因導致的免疫排斥、移植物抗宿主反應(GVHD)等,這將限制CAR-T細胞治療技術廣泛性和便捷性應用,同時也在一定程度上提高了該技術的成本,另外,對于一些經過多次放化療而摧毀免疫系統或者使T細胞功能弱化的腫瘤患者,其自體的T細胞是不適合制備CAR-T進行腫瘤治療的。所以,通用型CAR-T技術將是今后的一個方向,在基因編輯技術如CRISPER-Cas9等的進步下,如果能夠實現對健康供體來源的T細胞TCR及其他導致不同個體間免疫原性的基因的敲除,將會使CAR-T這一技術真正成為一種活的藥物,進而能夠廣泛而方便的供合適的患者使用,并極大地降低成本。第三代基因編輯技術CRISPR-Cas9是來自細菌的天然基因編輯工具,可高效精確地插入、剪切和改寫基因;與第一代ZFN和第二代TALEN技術相比,具備低脫靶率、高效(剪切效率是TALEN的100倍)、經濟實惠(從5000美元降低到30美元)、應用范圍廣(全部基因組)等明顯優勢,是基因編輯領域突破性的進展。由于其突破性的技術進展,CRISPR技術目前已研究應用于遺傳缺陷、癌癥、艾滋病等難治病領域,并取得多項驚人成果,未來想象空間無限大。CAR-T療法行業的參與者已經意識到CAR-T和CRISPR技術結合是必然趨勢。
目前幾乎所有的CAR-T療法公司都和基因編輯公司開展合作,包括諾華、Juno和Cellectis在內的6家CAR-T療法企業與IntelliaTherapeutics、EditasMedicine和CRISPRTherapeutics等基因編輯公司強強聯合,開發結合基因編輯技術特別是CRISPR技術的CAR-T療法。目前已有二代基因編輯技術結合CAR-T成功案例,且CAR-T公司大多與CRISPR公司簽訂發展2.0版CAR-T的巨額合作協議。CRISPR 技術突破性的進展使得其可高效多點地定向編輯T細胞,有效解決現有CAR-T療法的副作用劇烈、實體瘤效果較差、個體療效差異大以及難商業化等問題,CRISPR技術應用到CAR-T療法成為必然。我們判斷,結合CRISPR技術的CAR-T療法將成為下一代CAR-T療法的主流發展方向,有望迅速推進臨床試驗并實現工業化生產。
公司開發基于健康供體T細胞的新型嵌合抗原受體T細胞免疫療法(CAR-T),即通用型CAR-T技術,以用于多種癌癥的治療。用健康人的T細胞進行修飾后的細胞治療:1)使用CRISPR 定向敲除免疫排斥反應的相關基因,降低免疫排斥,實現異體細胞治療;2)轉入CD19特異性的嵌合抗原受體(CAR),從而實現ALL的靶向治療。摸索及優化基因敲除技術,以及大規模制備涉及的條件優化。完成臨床前研究,開展針對CD19抗原的通用型CAR-T細胞治療。
3.2.5 BG-MUC1(MUC1-CAR-T)
背景:眾所周知,針對CD19靶點的CAR-T臨床試驗取得了巨大進展。然而,CAR-T技術在實體腫瘤上的探索才剛剛開始,在已開展的臨床試驗中沒有表現出類似血液腫瘤的治療效果,顯示出CAR-T技術在實體腫瘤治療上還有很長的道路要走,還有許多技術困難需要克服。
實體腫瘤龐大的患者群體、以及較低的5年治療生存率,使得CAR-T技術應用于實體腫瘤的治療成為了普遍關注的焦點。在實體腫瘤的CAR-T治療上,腫瘤免疫微環境的抑制作用、CAR-T細胞的歸巢受損、CAR-T細胞浸潤腫瘤組織時遇到的胞外基質屏障、以及實體腫瘤內部高度缺氧的環境等等,都成為了CAR-T技術在實體腫瘤治療上需要解決的技術難題。還有更為重要的一點是:實體腫瘤缺少特異性非常高的治療靶點嚴重限制了CAR-T在實體瘤治療中的應用。由于CAR-T細胞識別的腫瘤相關抗原通常也會在正常細胞表達,使得CAR-T細胞的安全性成為首要考量的因素。同時,由于許多腫瘤組織沒有理想的CAR-T靶點,造成了CAR-T技術適應癥比較狹窄。
公司為了克服上述提及的諸多挑戰,重點開發以MUC1作為實體瘤治療靶點的CAR-T技術。MUC1屬于粘蛋白家族成員,是一種分布于多種正常黏膜的高分子量的糖粘蛋白分子。目前粘蛋白家族已知的成員有10 余種,其中以MUC1研究最為廣泛,且最具有應用前景。MUC1多分布于胃腸道、乳腺、呼吸道、胰腺等部位正常上皮細胞的頂端膜上,高度C-糖基化,起到保護上皮細胞的作用,同時可以介導細胞間的信號轉導作用及免疫調節。雖然MUC1表達在多種正常細胞表面,但在多種腫瘤中(卵巢癌、肺癌、胰腺癌、前列腺癌、胃癌、結直腸癌等),MUC1往往呈現異常表達,最高可達正常的100倍以上,而且喪失極性分布,并出現異常糖基化及結構改變。MUC1分子在正常細胞和腫瘤細胞表面的結構對比可知:由于腫瘤細胞表面表達的MUC1呈現異常糖基化,使得這類MUC1分子成為CAR-T治療中具有臨床意義的治療靶點。
美國國家癌癥研究所的試點項目列舉的75種具有腫瘤相關抗原潛能的蛋白中,MUC1名列第二。但是MUC1分子的復雜結構會造成MUC1抗體對MUC1識別的空間障礙,影響CAR-T治療效果。因此,公司開發出了可以選擇性識別腫瘤細胞異常糖基化的MUC1分子的抗體序列。BG-MUC1(MUC1-CAR-T)項目初步證實了MUC1作為CAR-T技術治療靶點的可行性,為實體腫瘤CAR-T腫瘤開辟了新的發展方向。
3.2.6 BG-EGFRvIII(EGFRvIII-CAR-T)
背景:表皮生長因子受體(EGFR)在眾多實體瘤中有高表達,而III型突變體(EGFRvIII)是EGFR中最常見的變異。EGFRvIII變異主要集中在胞外區域,包括有267個氨基酸缺失的外顯子框內缺失突變等。該變異體多見于神經膠質母細胞瘤(Glioblastoma,GBM)、乳腺癌、肺癌、頭頸鱗狀細胞癌等實體瘤。其中,針對EGFRvIII的免疫療法多集中在原發性神經膠質母細胞瘤。這是因為約30%的神經膠質母細胞瘤患者有特異性EGFRvIII表達,而人體正常細胞不會表達EGFRvIII。因此選擇EGFRvIII蛋白作為靶抗原的CAR-T免疫治療可能比其他CAR-T細胞治療有較少的副作用發生。
一項由諾華和賓夕法尼亞大學共同合作的治療神經膠質母細胞瘤I期臨床試驗顯示,靶向EGFRvIII抗原的CAR-T通過靜脈回輸后沒有出現腫瘤脫靶毒性和細胞因子釋放綜合征的副作用。而且血液中的CAR-T EGFRvIII細胞能穿越血腦屏障到達膠質瘤組織。在此基礎上,公司開發出了可特異性識別腫瘤EGFR III型突變體(EGFRvIII)的抗體序列,可有助于提高BG-EGFRvIII(EGFRvIII-CAR-T)的療效。項目初步證實了EGFRvIII可作為作為CAR-T治療的靶點,公司將對其繼續進行優化,完成臨床前研究。
3.2.7 BG-EGFR(EGFR-CAR-T)
背景:表皮生長因子受體(EGFR)是一個跨膜蛋白,可與表皮生長因子(EGF)、轉化生長因子(TGFα)、肝素結合性表皮生長因子(HB-EGF)、雙調節蛋白(amphiregulin)等一系列表皮生長因子結合。激活后的EGFR會形成雙聚體,活化胞內的蛋白酪氨酸激酶,使下游信號蛋白自體磷酸化并調控下游基因的表達,最后影響細胞的遷移、粘附和增殖。目前已有幾個靶向EGFR的抗癌小分子藥物,但EGFR的耐藥突變使藥物的療效大打折扣。相比起小分子藥,以EGFR抗原為靶點的CAR-T免疫治療法在非小細胞肺癌病人中實現部分應答。
目前CAR-T在實體瘤的應用受限,很大原因是由于為腫瘤微環境對CAR-T細胞歸巢的影響。T細胞的遷移主要依賴細胞趨化因子及其受體配對的引導。近年有報道,催化因子CXCL13(也稱B細胞趨化因子,BLC1)在90%的云南宣威市非小細胞肺癌病人的腫瘤組織中有高表達。除此以外,CXCL13和受體CXCR5高表達也常見于前列腺癌、胰腺癌、乳腺癌等組織。CXCR5一般表達于循環B細胞,少數的CD4+和CD8+T細胞以及皮膚衍生的遷移樹突狀細胞。攜帶CXCR5受體的淋巴細胞因此可遷移到CXCL13高表達的次級淋巴結和腫瘤部位。CXCR5+CD8+ T細胞已被發現富集于人的直腸癌組織和相鄰的淋巴結。因此,公司利用CXCR5/CXCL13腫瘤靶向的特性,研發CXCR5高表達并靶向EGFR抗原的CAR-T細胞產品。經優化后BG-EGFR(EGFR-CAR-T)設計可引導改造后的T細胞向腫瘤遷移,從而有望解決現有CAR-T療法實體瘤效果較差的問題。


